英孚立昔肠黏膜丢失与克罗恩病初治失反应关联研究
作者:admin 来源:未知 日期:2021-01-21 08:30人气:
肖军华 贺志龙 陈冰心 高苏俊 张永凯 许春芳
苏州大学附属第一医院消化内科 扬州苏北人民医院 上海中医药大学附属普陀医院
摘 要:
目的 部分克罗恩病(Crohn′s disease,CD)患者对抗肿瘤坏死因子a(TNF-α)药物治疗无效,并且其机制未明,如英夫利昔单抗(Infliximab,IFX)。探讨抗TNF-α单抗(英孚利昔单抗)是否因肠道黏膜损伤而经肠粘膜丢失,从而降低了英孚利昔的血药浓度,从而影响CD患者的治疗疗效。方法 收集32例初次接受英夫利昔单抗治疗的中度至重度活动期回结肠型CD患者(CDAI> 220)的2周内的粪便样本。采用酶联免疫吸附试验测定粪便中英夫利昔单抗浓度,同时测定患者第2周的血清英孚利昔单抗浓度。并分别于英夫利昔单抗治疗后2周、8周和3个月评估临床和内镜治疗反应。结果 收集的179份粪便样本中135份检出英夫利昔单抗(75.4%),最高浓度出现在第一次用药后的第一天。在第2周,临床无反应的患者,其第一天粪便英夫利昔单抗浓度显著高于有临床反应的患者[(7.01±0.71)mg/mL vs.(1.04±0.58)mg/mL,P=0.031],而粪便中英夫利昔单抗浓度和血清中英夫利昔单抗浓度无相关性。结论 英夫利昔单抗经过肠道丢失到CD患者的粪便中。治疗后第一天粪便中英夫利昔单抗的高浓度与初治无反应相关。需要进一步的研究来确定抗体是如何通过肠粘膜丢失的,以及这一过程又是如何影响治疗的反应。
关键词:
英孚立昔单抗 失反应 克罗恩 肠黏膜损伤
Loss of infliximab into feces is associated with lack of response to therapy in patients with Crohn′s disease
XIAO Junhua HE Zhilong CHEN Bingxin GAO Sujun ZHANG Yongkai XU Chunfang
Department of Gastroenterology,the First Affiliated Hospital of Soochow University;
Abstract:
Objective It is not clear that some patients with crohn′s disease do not respond to treatment with anti-tumor necrosis factor(anti-TNF)agents,such as infliximab. We investigated whether loss of anti-TNF agents through intestinal mucosa reduces the efficacy of infliximab in patients with CD. Methods We collected fecal samples from 32 consecutive patients with moderate to severely active CD during the first 2 weeks of infliximab therapy. Infliximab concentrations were measured in serum and supernatants of fecal samples using an ELISA. Clinical and endoscopic responses were assessed 2 and 8 weeks and 3 months after treatment began. Results Infliximab was detected in 135 of 179 fecal samples(75.4%). The highest concentrations were measured in the first days after the first infusion. Patients that were clinical non-responses at week 2 had significantly higher fecal concentrations of infliximab after the first day of treatment than patients with clinical responses(median concentration,7.01 ±0.71 mg/mL in nonresponders vs. 1.04 ± 0.58 mg/mL in responders,P = 0.031). We did not observe a correlation between fecal and serum concentrations of infliximab. Conclusions Infliximab is lost into stools of patients with CD. High fecal concentrations of infliximab in the first days after therapy begins are associated with primary nonresponse.
Keyword:
infliximab; lack of response; crohn′s disease; mucosal injury;
克罗恩病(Crohn′s disease,CD)由于其致病机理未明,目前仍没有根治方法,近年来CD在亚洲国家发病率呈上升趋势[1]。CD常用药物治疗反应差,且难以达到黏膜缓解,并发症多,易产生瘘管、狭窄,手术率高,术后易复发,伴随失去工作能力的高风险。抗TNF-α单克隆抗体的应用改善了IBD的诊治以及预后[2]。英孚利昔单抗(Infliximab,IFX)是一类嵌合的抗TNF抗体,是CD目前最为有效的治疗措施,抗肿瘤坏死因子的使用,降低了CD的手术率以及并发症的发生率。然而,还有一定数量的患者TNF抗体治疗仍无效(有约1/3的CD患者对于IFX初治无效),而另外一些患者经过一段时间治疗后演变为继发性无效[3]。这两种现象的原因及其机制依然不明。
IFX初治无效临床定义是经IFX诱导治疗不能改善临床症状和体征[4]。在最初的英夫利昔单抗治疗难治性CD的“Targan”研究中,IFX初治有效被定义为4周后克罗恩病活动指数CDAI(Crohn′s disease activity index,CDAI)降低70[5]。目前大多数临床研究将连续两次至少5 mg/kg英夫利昔单抗输注后,在4周评估缺乏反应定义为初治无效[6-8]。治疗无效常与血清药物低浓度和或体内产生药物中和抗体相关[9-11]。然而,IFX初治无效的原因在很大程度上依然是未知的,虽然目前已经提出了一些可能的机制:包括药代动力学或药效学方面或者两者都有[12-13]。前者可能是由于疾病的高炎症状态与过量的TNF-α负荷,和/或抗肿瘤坏死因子抗体的产生。后者可能是由于非TNF-α介导的免疫炎症性反应的机制主导。初治无效的另一种机制是抗体清除增强导致药物浓度不足。单克隆抗体的清除受多种因素的影响,包括体重指数、性别、同时使用免疫抑制剂、血清白蛋白浓度和炎症负荷[14-16]。近期研究表明,粪便中抗体的丢失可能代表着一个可能的机制:从“渗漏的肠道”中增加药物清除,导致对重症UC病人的治疗效果不佳[17]。为了证实CD患者IFX初治无效是否有IFX肠道渗漏相关,本研究进行了以下实验。
1 对象与方法
1.1 研究对象
回顾分析了2016年9月至2019年9月期间苏州大学附属第一医院消化科住院的回结肠型CD患者。入选患者符合我国CD诊断指南标准[18],包括临床、内镜、以及组织学表现。并经激素及免疫抑制剂失效;既往未使用IFX治疗;病变部位位于回结肠的CD患者。排除标准:年龄在16岁以下、70岁以上;肝、肾功能不全,心功能不全;妊娠期;碘过敏患者;既往使用过抗肿瘤坏死因子α治疗的患者。入选后,所有患者应用5 mg/kg IFX静脉注射治疗。同时收集入选患者5个时间点的粪便,分别为第1、4、7、10、14天。收集入选患者临床基线参数:包括CDAI、内镜下评分SES-CD(≤3为缓解,4~10轻度,11~19中度,≥20为重度),以及临床实验室指标(HB,白蛋白,CRP、ESR)。应用CDAI评估临床活动:其中CDAI≤150,认为CD患者疾病处于缓解期、CDAI>150,应为CD患者疾病处于活动期,并结合临床资料进行生化检测(包括ESR,CRP,全血细胞计数,和纤维蛋白原)以及血清IFX浓度(第2周),以及肠镜(入选时及第8周)。所有入选患者均告知其相关信息及权益,并签署知情同意书。
1.2 研究方法
粪便处理:收集的粪便样本用含6%胎牛血清的磷酸盐缓冲液1∶5稀释后,涡旋60 min,3 000 g离心5 min,取上清存储在-20℃冰箱。利用ELISA试剂盒(Sanquin Biologicals Laboratory,Amsterdam,The Netherlands)测定IFX第二周血清浓度以及粪便浓度浓度。在第2月及3月评估患者临床及内镜反应。
1.3 判定标准
临床有效定义为:CDAI下降>70。内镜有效定义为:SES-CD≤3。入选患者32例(男18例,年龄中位数48岁,范围16~61岁,病程中位数39个月,范围7~29个月)。
1.4 统计学方法
应用SPSS 20.0进行数据分析。所有连续变量均用表示。两组间的IFX血清及粪便浓度组间差异应用t检验进行分析,当非正态分布时,采用t′检验,IFX血清浓度与粪便浓度关联采用线性相关分析检验。P<0.05为差异有统计学意义。
图1 粪便中英孚立昔单抗浓度
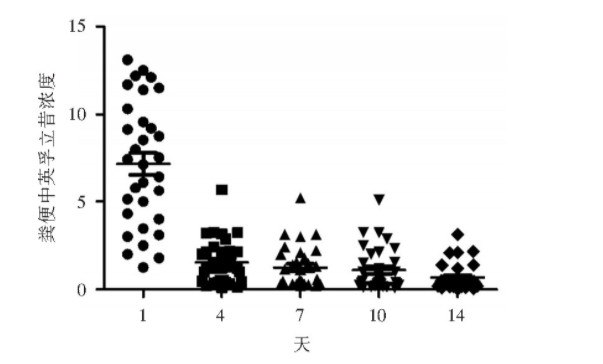



2 结果
2.1 入选CD患者粪便IFX检测结果
32位中重度回结肠型既往未接受IFX治疗的CD患者入选。所有入选患者在第0、2、6周接受5 mg/kg IFX治疗。在IFX治疗后的前2周,32名患者中有27人(84.3%)的粪便中检测到IFX,所有粪便样本中有135人次(75.4%)的粪便中检测到IFX。在首次注射IFX后的第1天测定的浓度最高[粪便浓度第1天:(7.14±0.87)mg/mL],见图1。其中第1天,在32例患者中的27例粪便样本中检测到IFX。粪便IFX浓度随着时间持续下降。
表2 第2周临床反应率
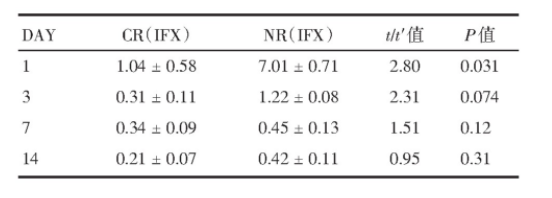

表3 第8周内镜反应率
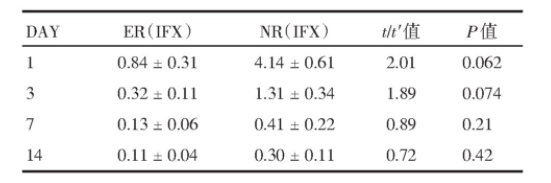

表4 第3月临床反应率
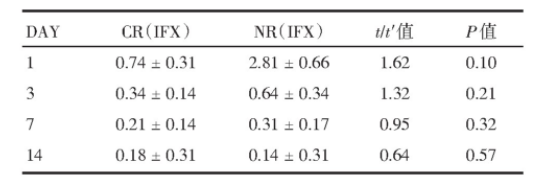

表5 早期预测内镜改善指标
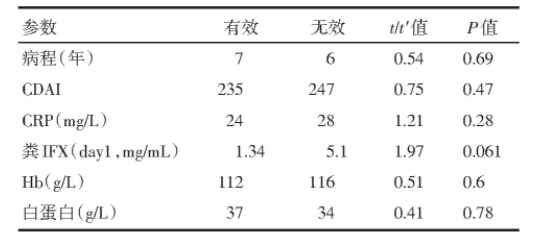

第2周,血清中IFX浓度为(22.15±7.17)mg/mL。临床有应答者:第2周观察32例患者中的21例(67.7%),第3月观察32例患者中的17例(53.1%)(表1)。
2.2 CD患者粪便IFX与临床及内镜应答
32例患者中28例在第8周进行了第二次内窥镜检查,其中有12例(42.9%)有内镜改善(SES-CD≤3)。第2周时,无应答者在注射IFX后第1天粪中IFX浓度显著高于第2周有应答者[(7.01±0.71)mg/mL vs.(1.04±0.51)mg/mL,P=0.031],见表2。8周后内镜无改善者,其粪便IFX相比内窥镜评分改善的浓度较高[(4.14±0.61)mg/mL vs.(0.84±0.31)mg/mL,P=0.062],见表3,但差异无统计学意义。
3月临床无应答者,粪便IFX浓度更高[(2.81±0.56)mg/mL vs.(0.74±0.24)mg/mL,P=0.10],如表4,但差异无统计学意义。
2.3 CD患者粪便IFX与血清IFX和临床参数的相关性分析
进一步分析了包括C-反应蛋白(CRP)、血红蛋白、血清白蛋白以及CDAI在内的多种生化及参数,其中粪IFX在第1天的浓度是内镜对IFX反应的唯一预测因子(表5)。临床无应答者第2周血清IFX中位浓度为(21.55±5.12)mg/mL,而应答者为(23.15±6.32)mg/mL。没有直接观察第一天IFX粪便水平和第二周IFX血清水平之间的相关性(r=-0.1 988,P=0.60,图2)。
图2 粪便IFX浓度与血清IFX浓度相关性
3 讨论
本研究证实肠内抗TNF-α抗体丢失与有关中度至重度活动期CD患者IFX初治无效有关。本实验表明粪便IFX浓度峰值为第一次注射大约1 d后,IFX最大的损失发生在血清药物浓度最高时,且黏膜炎症最重,因此,造成漏出的单抗最多。粪便中IFX明显丢失的患者基线病情更为严重。患者基线血清白蛋白浓度、CRP、HB以及CDAI在预测IFX初治反应,无明显价值。因为主要由回结肠疾病CD患者,疾病程度及粪便流失情况两者之间无显著相关性。
本研究只包括了CD患者,未纳入溃疡性结肠炎患者。然而,国外的一项研究中,入选和分析了IFX治疗UC患者的粪便样本。其中大部分患者的粪便也测量出IFX,这表明这种途径的抗体丢失可能并不局限于CD[17]。在本研究中,观察到初治无效较以前报道的高[19],这很可能是由于这个特殊的队列主要由中重度活动性克罗恩病(CDAI>220分)患者组成。虽然IFX的粪便丢失似乎是CD的初治无效的原因,但它可能不是影响IFX的药代动力学唯一的因素[9-10]。早期粪便IFX浓度和第14天血清IFX浓度之间缺乏相关性,可由其他影响药物血清浓度的因素来解释。尽管有人认为IFX血清药物浓度与临床效果高度相关,最近的数据表明,黏膜浓度可能更重要的是,至少在严重的结肠炎中,结肠黏膜IFX浓度与临床疗效相关[20]。研究表明,黏膜抗TNF-α浓度与组织抗IFX单抗的比值,结肠炎症严重部位其水平低于正常对照组,这表明黏膜炎症是抗体丢失的可能原因[21]。结肠黏膜以及粪便IFX浓度可能可以预测CD初治患者有效性。
而本研究发现,血清英孚利息浓度与粪便IFX浓度无相关性,IFX的粪便丢失可能只是IFX清除途径之一,还受其他因素影响。研究表明,IFX粪便内浓度其与网状内皮系统内蛋白水解的相关。最近,利用荧光抗体的分子成像在肠道黏膜显示结合TNF-α阳性的免疫细胞被认为是预测生物治疗反应的一种潜在模式[22]。粪便中单克隆抗体的丢失也可能只是代表疾病活动程度,而与初治反应无因果关系。它还可以认为是疾病活动的生物标志物,可识别结肠切除术的高风险患者[23]。最近有研究表明肠道纤维化也可以降低IFX治疗CD疗效[24],可能与降低病变肠黏膜IFX浓度有关。
本研究表明,抗TNF-α单抗可以在CD粪便中可被检测到。但本研究可能保守估计了经肠道抗体丢失的数量,因为渗漏出的抗体蛋白可能已经被大量肠腔的蛋白酶降解部分。并且这项研究中使用的试剂盒只能检测完整的抗体和Fab2片段,但无法检测Fab片段或其他/进一步降解了的IFX片段。另外,粪便经过了冷冻保存了几周才进行IFX浓度检测,因此,部分抗体降解不能排除在外。另外,考虑患者的依从性,以及减少小肠粘膜损伤的粪便IFX浓度的影响,本研究只纳入了回结肠型CD患者,且纳入患者数量较少,纳入中心单一,仍需更多临床治疗病例进一步证实IFX肠渗漏与IFX初治疗效的关系。
综上所述,肠内IFX的丢失在中重度CD与IFX初治无效有关。因此,重症患者可能可以从更大剂量的给药方案中,增加黏膜及血清IFX浓度从而获益。
参考文献
[1]何琼,李建栋.炎症性肠病流行病学研究进展[J].实用医学杂志,2019,35(18):2962-2966.
[2]TORRES J,BONOVAS S,DOHERTY G,et al.ECCO guidelines on therapeutics in Crohn′s disease:Medical treatment[J].J Crohns Colitis,2020,14(1):4-22.
[3]SINGH S,GEORGE J,BOLAND B S,et al.Primary non-response to tumor necrosis factor antagonists is associated with inferior response to second-line biologics in patients with inflammatory bowel diseases:A systematic review and meta-analysis[J].J Crohns Colitis,2018,12(6):635-643.
[4]VERMEIRE S,GILS A,ACCOSSATO P,LULA S,MARRENA.Immunogenicity of biologics in inflammatory bowel disease[J].Therap Adv Gastroenterol,2018,11:1756283X17750355.
[5]LICHTENSTEIN G R,BALA M,HAN C,et al.Iniximab improves quality of life in patients with Crohn′s disease[J].In amm Bowel Dis,2002,8(4):237-243.
[6]LOPETUSO L R,GERARDI V,PAPA V,et al.Can we predict the efficacy of anti-TNF-αagents[J].Int J Mol Sci,2017,18(9):1973.
[7]VAN HOEVE K,DREESEN E,HOFFMAN I,et al.Efficacy,pharmacokinetics,and immunogenicity is not affected by switching from infliximab originator to a biosimilar in pediatric patients with inflammatory bowel disease[J].Ther Drug Monit,2019,41(3):317-324.
[8]VANDE CASTEELE N,KHANNA R,LEVESQUE B G,et al.The relationship between infliximab concentrations,antibodies to infliximab and disease activity in Crohn′s disease[J].Gut,2015,64(10):1539-1545.
[9]KENNEDY N A,HEAP G A,GREEN H D,et al.Predictors of anti-TNF treatment failure in anti-TNF-naive patients with active luminal Crohn′s disease:A prospective,multicentre,cohort study[J].Lancet Gastroenterol Hepatol,2019,4(5):341-353.
[10]HEMPERLY A,VANDE CASTEELE N.Clinical pharmacokinetics and pharmacodynamics of infliximab in the treatment of inflammatory bowel disease[J].Clin Pharmacokinet,2018,57(8):929-942.
[11]VAN HOEVE K,DREESEN E,HOFFMAN I,et al.Higher infliximab trough levels are associated with better outcome in paediatric patients with inflammatory bowel disease[J].J Crohns Colitis,2018,12(11):1316-1325.
[12]CHOI S Y,KANG B,CHOE Y H.Serum infliximab cutoff trough level values for maintaining hematological remission in pediatric inflammatory bowel disease[J].Gut Liver,2019,13(5):541-548.
[13]VERMEIRE S,GILS A,ACCOSSATO P,et al.Immunogenicity of biologics in inflammatory bowel disease[J].Therap Adv Gastroenterol,2018,11:1756283X17750355.
[14]MURDACA G,SPANÒF,CONTATORE M,et al.Immunogenicity of infliximab and adalimumab:What is its role in hypersensitivity and modulation of therapeutic efficacy and safety[J].Expert Opin Drug Saf,2016,15(1):43-52.
[15]MATSUOKA K,HAMADA S,SHIMIZU M,et al.Factors contributing to the systemic clearance of infliximab with long-term administration in Japanese patients with Crohn′s disease:Analysis using population pharmacokinetics[J].Int J Clin Pharmacol Ther,2020,58(2):89-102.
[16]GIBSON D J,HARTERY K,DOHERTY J,et al.CRP/Albumin Ratio:An Early Predictor of Steroid Responsiveness in Acute Severe Ulcerative Colitis[J].J Clin Gastroenterol,2018,52(6):e48-e52.
[17]BRANDSE J F,VAN DEN BRINK G R,WILDENBERG M E,et al.Loss of Infliximab Into Feces Is Associated With Lack of Response to Therapy in Patients With Severe Ulcerative Colitis[J].Gastroenterology,2015,149(2):350-355.
[18]中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见[J].中国实用内科杂志,2018,38(9):796-813.
[19]LICHTENSTEIN G R,FEAGAN B G,COHEN R D,et al.Infliximab for Crohn′s Disease:More Than 13 Years of Real-world Experience[J].Inflamm Bowel Dis,2018,24(3):490-501.
[20]D′HAENS G,VERMEIRE S,LAMBRECHT G,et al.Increasing infliximab dose based on symptoms,biomarkers,and serum drug concentrations does not increase clinical,endoscopic,and corticosteroid-free remission in patients with?Active Luminal Crohn′s Disease[J].Gastroenterology,2018,154(5):1343-1351.
[21]YARUR A J,HAUENSTEIN S,SUSSMAN D,et al.The association of tissue anti-TNF drug levels with serological and endoscopic disease activity in inflammatory bowel disease:the AT-LAS study[J].Gut,2016,65(2):249-255.
[22]ATREYA R,NEUMANN H,NEUFERT C,et al.In vivo imaging using fluorescent antibodies to tumor necrosis factor predicts therapeutic response in Crohn′s disease[J].Nat Med,2014,20(3):313-318.
[23]GIBSON D J,HEETUN Z S,REDMOND C E,et al.An accelerated infliximab induction regimen reduces the need for early colectomy in patients with acute severe ulcerative colitis[J].Clin Gastroenterol Hepatol,2015,13(2):330-335.
[24]DE BRUYN J R,BECKER M A,STEENKAMER J,et al.Intestinal fibrosis is associated with lack of response to Infliximab therapy in Crohn′s disease[J].PLoS One,2018,13(1):e0190999.


