白藜芦醇对长期高热量饮食小鼠海马神经元及认知水平的影响
作者:admin 来源:未知 日期:2021-04-13 08:50人气:
摘 要:
目的 通过观察白藜芦醇对长期高热量饮食小鼠海马神经元内质网应激凋亡相关因子的影响,探讨其对长期高热量饮食小鼠海马神经元及认知水平的神经保护机制。方法 采用高热量饮食诱发肥胖相关认知功能障碍小鼠模型,并给予白藜芦醇干预24周,测定其体重、糖耐量和胰岛素耐量,新物体识别实验和Morris水迷宫检测其认知水平,逆转录—聚合酶链式反应和酶联免疫吸附试验检测其海马组织葡萄糖调节蛋白(GRP78)、CCAAT/增强子结合蛋白同源蛋白(CHOP)、半胱氨酸天冬氨酸蛋白酶12 (Caspase12) mRNA和蛋白质表达水平。结果 经白藜芦醇干预后,高热量饮食小鼠体重在一定程度上得到控制,葡萄糖耐量和胰岛素耐量有所改善,新物体相对识别指数和水迷宫游程百分比均显著增加,水迷宫逃避潜伏路程显著缩短,海马神经组织GRP78、CHOP、Caspase12的表达均显著降低。结论 白藜芦醇可修复高热量饮食诱导的糖耐量和胰岛素耐量受损状况,并通过改善海马神经组织内质网应激及其介导的凋亡,改善高热量饮食小鼠认知功能障碍。
关键词:
白藜芦醇 高热量饮食 认知功能障碍 内质网应激
Effects of resveratrol on hippocampal neurons and cognitive function in mice treated by long-term high calorie diet
Dong Wen Liu Ben Lun Yong-zhi
Department of Laboratory Medicine, School of Pharmacy and Medical Technology, Putian University;
Abstract:
Objective To explore the effect and mechanism of resveratrol(RES) on the expression of the relative factors in endoplasmic reticulum stress-induced apoptosis in the hippocampus of mice treated by longterm high calorie diet, and also the cognition function of these mice. Methods A mice model of obesityrelated cognitive dysfunction was induced by high calorie diet feeding. RES was administrated for 24 weeks.For therapeutic evaluation, the body weight, glucose tolerance and insulin tolerance, cognitive function, and the mRNA and protein levels of glucose-regulated protein 78(GRP78), CCAAT/enhancer-binding protein homologous protein(CHOP) and cysteinyl aspartate specific proteinase 12(Caspase12) in hippocampus were monitored. Results After RES intervention, the weight of mice treated by high-calorie diet was controlled to a certain extent, their glucose tolerance and insulin tolerance were improved, the discrimination index in new object recognition experiment and percentage of swimming distance in water maze test were both significantly increased, while the escape distance in a water maze test was significantly shortened, and the expression of GRP78, CHOP and Caspase12 in hippocampus were all significantly reduced. Conclusion RES can repair impaired glucose tolerance and insulin tolerance induced by high calorie diet, and modulate the endoplasmic reticulum stress via inhibiting apoptosis in hippocampal to improve the cognitive dysfunction in mice treated by long-term high-calorie diet.
Keyword:
resveratrol; high calorie diet; cognitive dysfunction; endoplasmic reticulum stress;
随着全球经济的快速发展,人们的饮食结构逐渐发生变化,高糖高脂等高热量食物摄取逐渐增加,使得肥胖人口以每5年增加1倍的速度增长。研究[1—4]发现,长期高热量饮食易引起肥胖相关的中枢神经系统病变,出现学习记忆减退、认知功能障碍等问题,可能与高热量饮食诱发脑胰岛素抵抗、神经炎症、海马突触可塑性改变、神经细胞凋亡等因素有关。内质网是真核细胞内蛋白合成和翻译后修饰、折叠与装配的重要细胞器,其功能的正常化是细胞存活的必要条件。当高热量食物摄取导致的高血糖和高血脂进入细胞,内质网工作负担加重,功能发生改变,即产生内质网应激(endoplasmic reticulum stress,ERS)[5]。长期、过度的ERS会引起细胞代谢紊乱和凋亡。白藜芦醇(resveratrol,RES)是自然界中广泛存在的一种多酚化合物,具有抗氧化应激和抗炎作用,对动脉粥样硬化、脑卒中、高血压、心肌缺血、心衰等心脑血管疾病都有一定效果[6]。近年来发现其对高热量饮食所致肥胖相关认知功能障碍具有改善作用,但确切机制尚不清楚[7—8]。本研究探讨RES对长期高热量饮食小鼠海马神经元及认知水平的神经保护作用是否与ERS介导的细胞凋亡有关,为进一步明确RES的防控机制提供参考。
1 材料与方法
1.1 实验材料
6周龄SPF级雄性C57BL/6小鼠30只,质量(20±2) g,购于上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2017-0005。主要试剂与仪器:RES(美国Sigma公司)、ELISA试剂盒(北京雅安达生物技术有限公司)、PCR引物(上海生工生物工程有限公司)、新物体识别实验装置(北京吉安得尔科技有限公司)、Morris水迷宫(中国医学科学院药物研究所)、实时荧光定量PCR仪(美国Bio-Rad有限公司)。
1.2 实验方法
1.2.1 动物分组及喂养
小鼠适应性喂养1周后,随机分为对照组、高热量饮食(high calorie diet,HCD)组、HCD+100 mg/kg RES组(RES组),每组10只。根据分组喂养正常饲料和高糖高脂饲料,于12 h昼夜交替、室温(22±2)°C、相对湿度约(50±10)%的环境饲养24周,期间保证饮水自由。观察各组小鼠皮毛色泽、活动状态、精神状态等,每周测量体重。
用0.5%羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)溶解RES配置100 mg/kg的溶液,对RES组灌胃,另2组采用等体积生理盐水(含0.5%CMC-Na)灌胃。
1.2.2 动物认知水平检测
喂养24周后,各组小鼠进行新物体识别实验和Morris水迷宫。
新物体识别实验:实验包括3 d训练期和1 d测试期,在边长50 cm的正方体实验箱进行。训练期,将2个相同物体(A和B)对称置于实验箱中心位置,各组小鼠分别放入,自由探索5 min;测试期,将物体B更换为新物体C,当其头部面向物体,且两者距离≤2 cm时则视其正在探索物体,观察并记录其5 min内对每个物体的探索时间。采用相对识别指数(discrimination index,DI)作为学习记忆的检测指标,

Morris水迷宫:实验包括5 d定位航行试验和1 d空间探索实验,在直径1.2 m、高0.5 m的圆形水池中进行。定位航行试验:将平台置于水下1.5~2.0 cm处,并保持。将各组小鼠分别面向池壁放入水中,记录其从入水到爬上平台所游路程,即逃避潜伏路程。空间探索实验:将水下平台撤除,记录小鼠首次到达原平台所在位置所游路程(视为第6天的逃避潜伏路程)及在原平台所在象限的游泳路程占总路程的百分比(即游程百分比)。
1.2.3 葡萄糖耐量试验(glucose tolerance test,GTT)和胰岛素耐量试验(insulin tolerance test,ITT)
认知水平检测结束后,各组小鼠禁食16 h,腹腔注射2 g/kg体重的葡萄糖,分别于0、30、60、90、120 min时尾静脉采血,测定血糖值,绘制GTT曲线。
各组小鼠禁食6 h后,腹腔注射1 U/kg体重的重组人胰岛素,分别于0、30、60、90、120 min时测定血糖值,绘制ITT曲线。
1.2.4 ELISA检测蛋白表达
各组小鼠处死后,迅速断头取海马组织,放入预冷的裂解液,低温下匀浆,离心取上清液,采用ELISA法检测海马组织葡萄糖调节蛋白(glucose-regulated protein 78,GRP78)、CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)和半胱氨酸天冬氨酸蛋白酶12 (cysteinyl aspartate specific proteinase 12,Caspase12)的含量。ELISA试剂盒室温平衡30 min后,按照说明书操作,用全自动酶标仪读取A450值。
1.2.5 逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)检测基因表达
将各组海马组织匀浆后,用液氮和Trizol试剂提取RNA,按照反转录试剂盒说明书,将RNA反转录合成c DNA,以c DNA为模板进行RT-PCR定量检测。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,每个实验重复3次。目的基因的相对表达量采用2-ΔΔCt法计算。PCR引物序列见表1。
表1 PCR引物序列

1.2.6 统计学分析
所有数据表示为平均值±标准差,采用SPSS 19.0进行统计分析。GTT、ITT及水迷宫数据采用多因素方差分析,其余数据采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 各组小鼠一般情况及体重变化
实验期间,各组小鼠均无异常死亡发生。随着周龄的增长,对照组小鼠保持皮毛清洁柔软、有光泽,日常行为灵敏活跃,而HCD组和RES组小鼠皮毛蓬乱、失润不整,性情较温顺,体型肥大,行动缓慢,慵懒不好动。
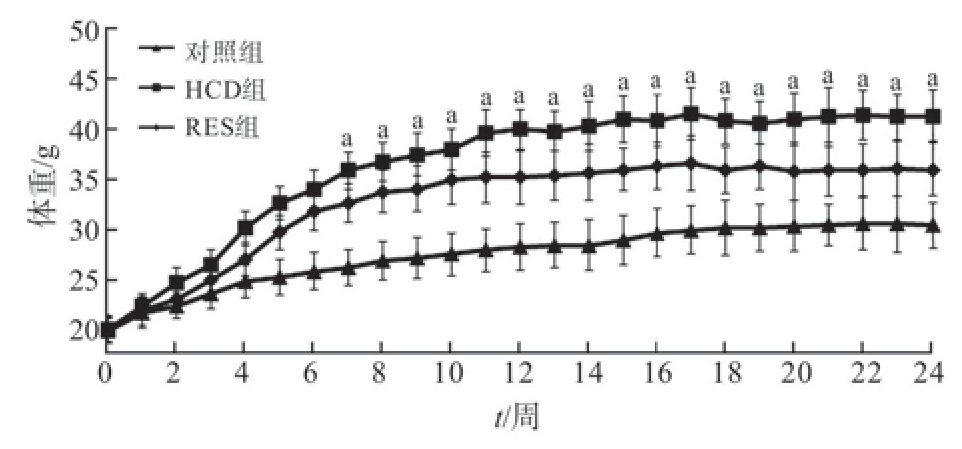
体重变化如图1所示,各组小鼠初始体重差异无统计学意义(P>0.05),随着饲养时间的延长,体重均呈递增趋势。7周后,HCD组小鼠体重较对照组显著升高(P<0.05);24周后,HCD组小鼠体重仍显著高于对照组(P<0.05),且>25%,达到肥胖标准。RES组小鼠体重较HCD组有所下降,但差异无统计学意义(P>0.05)。
图1 各组小鼠体重变化
2.2 各组小鼠葡萄糖耐量和胰岛素耐量变化
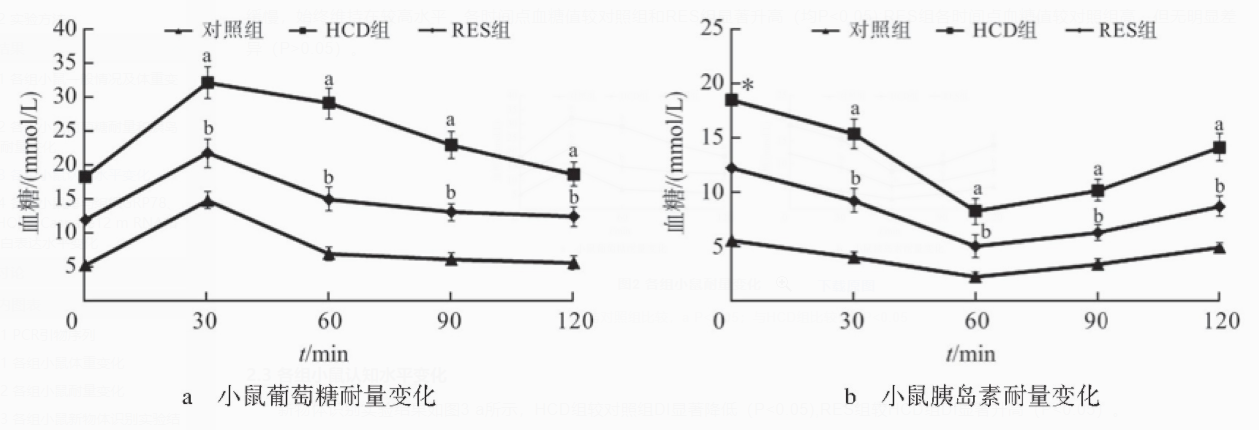
各组小鼠葡萄糖耐量变化如图2a所示,注射葡萄糖后,各组小鼠血糖值均有明显上升,到30 min时,达到峰值。其中HCD组小鼠在血糖峰值后,下降缓慢,血糖波动大,30、60、90、120 min时,血糖值较对照组和RES组显著升高(均P<0.05);RES组各时间点血糖值较对照组高,但无明显差异(P>0.05)。
胰岛素耐量变化如图2b所示,注射胰岛素后,各组小鼠血糖值均降低,到60 min时,达到谷值。其中HCD组血糖达到谷值后,上升缓慢,始终维持在较高水平,各时间点血糖值较对照组和RES组显著升高(均P<0.05);RES组各时间点血糖值较对照组高,但无明显差异(P>0.05)。
图2 各组小鼠耐量变化
2.3 各组小鼠认知水平变化
新物体识别实验结果如图3 a所示,HCD组较对照组DI显著降低(P<0.05),RES组较HCD组DI显著升高(P<0.05)。
Morris水迷宫逃避潜伏路程变化如图3b所示,第1、2天,各组小鼠逃避潜伏路程差异无统计学意义(P>0.05);第3、4、5、6天,HCD组较对照组逃避潜伏路程显著延长(均P<0.05),其中第5、6天,RES组较HCD组逃避潜伏路程显著缩短(P<0.05)。原平台所在象限的游泳路程占总路程的百分比结果如图3c所示,HCD组较对照组游程百分比显著降低(P<0.05),而RES组较HCD组百分比显著升高(P<0.05)。
2.4 各组小鼠海马组织GRP78、CHOP、Caspase12 m RNA和蛋白表达水平变化
RT-PCR检测结果如图4a所示,HCD组较对照组海马组织GRP78、CHOP、Caspase12 m RNA表达均显著升高(均P<0.05),RES组较HCD组海马组织GRP78、CHOP、Caspase12 m RNA表达均显著降低(均P<0.05)。
图3 各组小鼠新物体识别实验结果
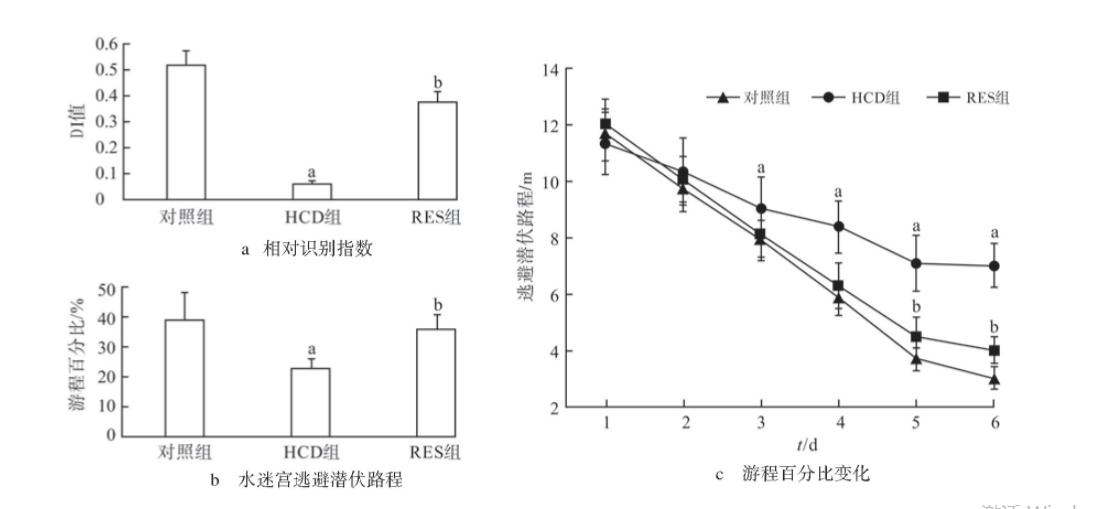
图4 各组小鼠海马组织GRP78、CHOP、Caspase12 m RNA蛋白质表达水平
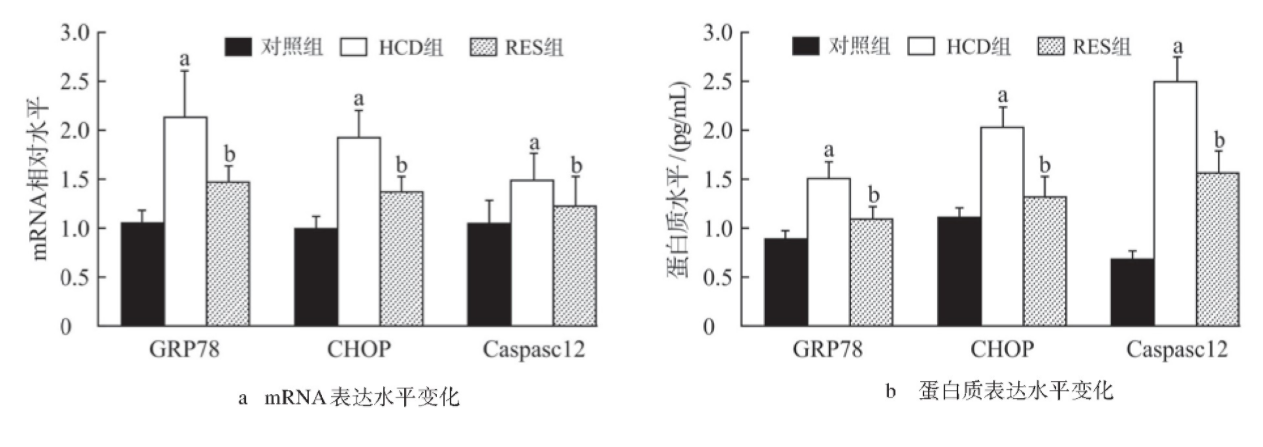
ELISA检测结果如图4b所示,HCD组较对照组海马组织GRP78、CHOP、Caspase12蛋白质表达均显著升高(均P<0.05),RES组较HCD组海马组织GRP78、CHOP、Caspase12蛋白质表达均显著降低(均P<0.05)。
3 讨论
本研究采用高热量饮食诱发肥胖相关认知功能障碍小鼠模型,结果显示经过相应处理的小鼠出现体重超重严重,且已达肥胖标准[9],葡萄糖调节机能受损,存在糖耐量及胰岛素耐量异常,对新物体的识别记忆能力显著降低,水迷宫逃避潜伏路程显著延长,游程百分比显著减少,海马依赖性学习记忆能力受损,提示肥胖相关认知功能障碍小鼠模型构建成功。通过在高热量食物中添加100 mg/kg RES在一定程度上控制了高热量饮食小鼠体重,修复了高热量饮食诱导的糖耐量和胰岛素耐量受损状况,使其对新物体的识别记忆能力显著提高,水迷宫逃避潜伏路程显著缩短,游程百分比显著增加,海马依赖性学习记忆能力亦有所改善,说明RES在高热量饮食所致肥胖及相关认知功能损伤中发挥有效保护作用,但是其具体保护机制尚未明确。
内质网是广泛存在于真核细胞中的重要细胞器,对蛋白质的合成、修饰及分泌,脂质的合成和Ca2+储存起关键作用,参与并维持着细胞稳态。内质网的正常功能由极强的内在体系所维持。但受到其他有害因素刺激时,如脂质过度负荷,氧化应激等,内质网稳态即被打破,触发ERS。研究[10]发现,ERS是细胞的一种自我保护机制,一定程度的ERS可能对细胞具保护作用,但过度的ERS将导致细胞损伤甚至凋亡。ERS引起的神经细胞损伤及凋亡与神经系统疾病的发生发展密切相关[11—12]。
GRP78是存在于内质网内的一种分子伴侣,参与蛋白质的糖基化修饰、折叠和转运,具维持细胞稳态和启动ERS的能力,被视为ERS发生的关键调控分子及标志蛋白之一。正常生理条件下,GRP78含量较少,ERS可促其表达,以减少内质网内未折叠蛋白的聚集,减轻内质网结构和功能的损伤;然而随着表达的进行,GRP78呈现出持续高表达状态,最终激发CHOP相关ERS介导凋亡通路。CHOP是一种ERS特异性凋亡转录因子,大量表达参与ERS介导的凋亡途径,其表达量在一定程度上可反映凋亡的水平。研究[13]发现,CHOP敲除的小鼠可有效抑制ERS介导的凋亡。CHOP是联系ERS与细胞凋亡的重要中间信号,即ERS激活CHOP,使下游凋亡相关基因Caspase12表达。Caspase12是半胱天冬酶家族成员之一,为内质网特异性膜蛋白,仅在ERS时被活化,是ERS介导凋亡信号通路中的终末分子。研究[14]发现,Caspase12特异性抑制剂能明显保护细胞免受ERS引发的凋亡,但其他死亡刺激仍可引发细胞凋亡。因此,Caspase12可能只参与ERS介导的凋亡,而与其他的凋亡机制无关。海马组织内的ERS引起海马神经细胞凋亡,是导致中枢神经系统病变及认知功能障碍发生发展的机制之一[15—16]。GRP78、CHOP和Caspase12是ERS介导凋亡的关键调控分子。本研究RT-PCR和ELISA结果显示,HCD组小鼠海马组织GRP78、CHOP、Caspase12m RNA及蛋白质表达均明显升高,说明高热量饮食小鼠海马神经细胞出现ERS介导的细胞凋亡,这可能与其认知功能障碍发生发展有关。在高热量食物中添加RES进行处理,上述分子的m RNA和蛋白质表达明显降低,说明RES可通过下调海马神经组织GRP78、CHOP、Caspase12的表达,缓解ERS及其介导的凋亡,改善高热量饮食小鼠认知功能障碍。
RES可在一定程度上控制高热量饮食小鼠的体重,修复其糖耐量和胰岛素耐量受损状况,并通过抑制海马神经细胞ERS及其介导的细胞凋亡,达到保护海马依赖性学习记忆能力的效果。这些结果揭示了RES对高热量饮食所致肥胖相关认知功能障碍的改善作用及其机制,为高热量饮食所致肥胖相关认知功能障碍的预防及临床治疗提供理论基础和实验依据。
参考文献
[1]Choi YS,Kang S,Ko SY,et al.Hyperpolarized[1-13C]pyruvate MR spectroscopy detect altered glycolysis in the brain of a cognitively impaired mouse model fed high-fat diet[J].Molecular Brain,2018,11(1):74
[2]Qin Su-ping,Sun De-xu,Mu Jing-jing,et al.Purple sweet potato color improves hippocampal insulin resistance via down-regulating SOCS3 and galectin-3 in high-fat diet mice[J].Behavioural Brain Research,2019,359:370-377
[3]Wang Qing-zhi,Yuan Jing,Yu Zhan-yang,et al.FGF21attenuates high-fat diet-induced cognitive impairment via metabolic regulation and anti-inflammation of obese mice[J].Molecular Neurobiology,2018,55(6):4702-4717
[4]Walker JM,Dixit S,Saulsberry AC,et al.Reversal of high fat diet-induced obesity improves glucose tolerance,inflammatory response,beta-amyloid accumulation and cognitive decline in the APP/PSEN1 mouse model of Alzheimer's disease[J].Neurobiology of Disease,2017,100:87-98
[5]朱军民,陈刚,秦俊杰,等.糖代谢异常和炎症对胃癌的影响[J].兰州大学学报:医学版,2018,44(1):83-88
[6]马颖,关怀,韦艳,等.白藜芦醇通过动力相关蛋白1减轻糖尿病小鼠心肌氧化应激的研究[J].兰州大学学报:医学版,2018,44(5):53-57
[7]Jeon BT,Jeong EA,Shin HJ,et al.Resveratrol attenuates obesity-associated peripheral and central inflammation and improves memory deficit in mice fed a high-fat diet[J].Diabetes,2012,61(6):1444-1454
[8]Li Shih-wen,Yu Hong-ren,Sheen JM,et al.A maternal high-fat diet during pregnancy and lactation,in addition to a postnatal high-fat diet,leads to metabolic syndrome with spatial learning and memory deficits:beneficial effects of resveratrol[J].Oncotarget,2017,8(67):111998-112013
[9]Hariri N,Thibault L.High-fat diet-induced obesity in animal models[J].Nutrition Research Reviews,2010,23(2):270-299
[10]Hood KN,Zhao J,Redell JB,et al.Endoplasmic reticulum stress contributes to the loss of newborn hippocampal neurons after traumatic brain injury[J].Journal of Neuroscience,2018,38(9):2372-2384
[11]Santos LE,Ferreira ST.Crosstalk between endoplasmic reticulum stress and brain inflammation in Alzheimer's disease[J].Neuropharmacology,2018,136(Pt B):350-360
[12]Kong Fei-juan,Ma Lei-lei,Guo Jun-jie,et al.Endoplasmic reticulum stress/autophagy pathway is involved in diabetes-induced neuronal apoptosis and cognitive decline in mice[J].Clinical Science (London),2018,132(1):111-125
[13]Wada S,Hatano E,Yoh T,et al.CAAT/enhancer binding protein-homologous protein deficiency attenuates liver ischemia/reperfusion injury in mice[J].Liver Transplantation,2018,24(5):645-654
[14]Jiang Shan,Xie Qing,Zhou Hui-juan,et al.Ribozymemediated inhibition of caspase-12 activity reduces apoptosis induced by endoplasmic reticulum stress in primary mouse hepatocytes[J].International Journal of Molecular Medicine,2008,22(6):717-724
[15]Hylin MJ,Holden RC,Smith AC,et al.Juvenile traumatic brain injury results in cognitive deficits associated with impaired endoplasmic reticulum stress and early tauopathy[J].Developmental Neuroscience,2018,40(2):175-188
[16]Tang Yi-yun,Wang Ai-ping,Wei Hai-jun,et al.Role of silent information regulator 1 in the protective effect of hydrogen sulfide on homocysteine-induced cognitive dysfunction:involving reduction of hippocampal ERstress[J].Behavioural Brain Research,2018,342:35-42


